Ein Forschungsteam der Universität Bayreuth hat den Prozess der Seidenherstellung in der Spinne erstmals entschlüsselt und auch im Detail erfolgreich nachgeahmt. Die auf diese Weise hergestellte biomimetische Spinnenseide zeigt die gleiche Belastbarkeit wie natürliche Spinnenseide.
Spinnenseide ist ein technologisch hochinteressantes Material, weil sie Festigkeit und Elastizität in einzigartiger Weise verbindet. Sie ist daher stärker belastbar als alle anderen in der Natur vorkommenden oder vom Menschen produzierten Fasern. Einem Forschungsteam an der Universität Bayreuth um Prof. Dr. Thomas Scheibel ist es jetzt erstmals gelungen, den Prozess der Seidenherstellung in der Spinne vollständig zu entschlüsseln und dabei die Gründe aufzuklären, weshalb Spinnenseide so außerordentlich belastbar ist. Aufbauend auf diesen Einsichten in das ‚Know-how‘ der Spinne haben die Wissenschaftler aus biotechnologisch hergestellten Spinnenseidenproteinen Fasern entwickelt, die genauso belastbar sind wie das natürliche Vorbild. In der Online-Ausgabe der Zeitschrift „Advanced Materials“ stellen sie ihre Forschungsergebnisse vor.
Biomimetik in den Bayreuther Laboratorien
Dem Forschungsteam am Lehrstuhl für Biomaterialien der Universität Bayreuth ist es gelungen, die in der Spinne ablaufenden Prozesse nicht nur zu entschlüsseln, sondern auch in fast allen Schritten nachzuahmen. „Das Ergebnis hat uns selbst überrascht“, berichtet Prof. Scheibel. „Denn die auf diesem Weg hergestellte biomimetische Seide besitzt tatsächlich eine mechanische Belastbarkeit wie natürliche Spinnenseide. Damit stehen die Türen jetzt weit offen für das Erkunden von Anwendungsmöglichkeiten, wie etwa in der Textilindustrie oder der Medizintechnik.“

Grundstrukturen der Spinnenseidenproteine
Jede Faser aus Spinnenseide enthält Millionen von Proteinen, die auf einzigartige Weise miteinander vernetzt sind. Jedes Protein besteht dabei aus drei Teilen, aus sogenannten Domänen: Eine lange Kette von kurzen, sich hundertfach wiederholenden Aminosäuresequenzen bildet die große Kerndomäne. An ihrem einen Ende befindet sich eine Molekülgruppe, die eine freie Aminogruppe enthält und deshalb „N-terminale Domäne“ heißt; am anderen Ende der Kette hängt eine Molekülgruppe, die wegen ihrer Carboxy-Gruppe (COOH) als „C-terminale Domäne“ bezeichnet wird.
„Die herausragenden Eigenschaften der Spinnenseide resultieren aus dem Zusammenspiel dieser drei Proteindomänen“, erläutert Prof. Scheibel. „Dabei hängen die Festigkeit, Elastizität und weitere mechanische Eigenschaften einer Seidenfaser entscheidend davon ab, aus welchen Aminosäuren sich die Kerndomäne zusammensetzt. In dieser Hinsicht gibt es große Unterschiede von Seidenart zu Seidenart und von Spinne zu Spinne. Die C- und die N-terminale Domäne sind hingegen bei allen Spinnen annähernd gleich. Sie übernehmen wichtige Steuerungsfunktionen, wenn es darum geht, die einzelnen Spinnenseidenmoleküle in eine reißfeste Seidenfaser zu verarbeiten. Die Bedeutung dieser beiden Steuerdomänen ist in früheren Forschungsarbeiten häufig unterschätzt worden.“
Von der kugelförmigen Mizelle bis zur fertigen Seidenfaser
Um Spinnenseidenfasern zu erhalten, die sich durch mechanische Eigenschaften wie in der Natur auszeichnen, muss sich der Herstellungs- und Verarbeitungsprozess weitgehend ander Spinne orientieren. In der Spinne finden sich die einzelnen, im Drüsengewebe entstandenen Proteine im Spinndrüsensack zusammen. Hier bilden sie – wie die Bayreuther Wissenschaftler herausgefunden haben – kugelförmige Strukturen (Mizellen), die Eigenschaften von Flüssigkristallen aufweisen. Die Kerndomänen der Seidenproteine sind im Inneren der Mizelle platziert, ihre Enddomänen befinden sich hingegen an der Mizellenoberfläche. Dabei sind die C-terminalen Domänen paarweise verknüpft, während die N-terminalen Domänen lose Enden bilden.
„Diese kugelförmige Anordnung der Seidenprotein-Paare ist eine extrem stabile Speicherform, die eine ungewollte Faserbildung komplett unterdrückt“, erklärt Prof. Scheibel. „Sie hat zugleich den Vorteil, dass sie die Seidenproteine so vororientiert, dass sie für eine rasche Faserproduktion zur Verfügung stehen.“ Denn sobald die Spinne eine Faser benötigt, drückt sie die Spinnlösung aus dem Drüsensack in den Spinnkanal. Hier werden störende Wassermoleküle, die sich noch an den Oberflächen der Seidenproteine befinden, entfernt. Zugleich sinkt der pH-Wert, so dass die bisher losen N-terminalen Domänen der Seidenprotein-Paare ihre Struktur schalterartig ändern und sich mit anderen N-terminalen Domänen verklammern. Durch die im Spinnkanal vorherrschenden Scherverhältnisse erhalten die vernetzten Seidenproteine ihre endgültige Ausrichtung als Fasern. Die Spinne kann die Fasern dann aus dem Spinnkanal herausziehen, indem sie beispielsweise ihre Hinterbeine zuhilfe nimmt.
Forschungsförderung
Die in „Advanced Materials“ veröffentlichten Forschungsarbeiten wurden von der Deutschen Forschungsgemeinschaft, insbesondere im Rahmen des an der Universität Bayreuth angesiedelten Sonderforschungsbereichs „From particulate nanosystems to mesotechnology“, sowie von der Technologie Allianz Oberfranken (TAO) gefördert. TAO ist ein Verbund der Universitäten Bayreuth und Bamberg sowie der Hochschulen für angewandte Wissenschaften Coburg und Hof. Die Partner kooperieren in den Bereichen „Energie“, „Mobilität“ und „Gesundheit“, die durch die Querschnittsthemen „Mensch und Technik“, „Werkstoffe“ und „IT/Sensorik“ miteinander verbunden sind.
Veröffentlichung
Aniela Heidebrecht, Lukas Eisoldt, Johannes Diehl, Andreas Schmidt, Martha Geffers, Gregor Lang, and Thomas Scheibel, Biomimetic Fibers Made of Rekombinant Spidrions with the same Toughness as Natural Spider Silk, in: Advanced Materials (2015), DOI: 10.1002/adma.201404234
Kontakt
Prof. Dr. Thomas Scheibel
Universität Bayreuth
Lehrstuhl für Biomaterialien
D-95440 Bayreuth
Tel.: +49 (0)921 / 55-7360
E-Mail: thomas.scheibel@uni-bayreuth.de
Anhang: Das Strukturgeheimnis der Spinnenseide
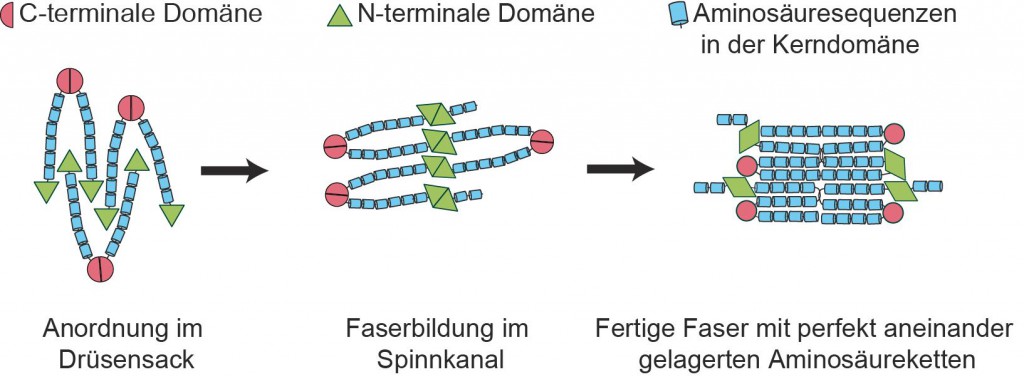
Das Bayreuther Forschungsteam hat entdeckt, dass die außerordentliche Festigkeit und Elastizität der Spinnenseide auf dem Aufbau der Seidenproteine und ihrer ungewöhnlichen Vernetzung beruht. Diese Vernetzung beginnt, indem sich jeweils zwei Proteine parallel nebeneinander legen und über ihre C-terminalen Domänen aneinander klammern. Diese Klammer wird durch eine zusätzliche chemische Bindung verstärkt. So entstehen sogenannte Dimere: Paare von Seidenproteinen, die an ihrem einen Ende gleichsam zusammengebunden sind. Die N-terminalen Domänen bleiben dagegen zunächst partnerlos. In genau diesem ‚halbvernetzten‘ Zustand befinden sich die Proteine in der Mizelle.
Im Spinnkanal wird die Vernetzung dann vervollständigt. Hier ändern die N-terminalen Domänen ihre Struktur, sobald der pH-Wert sinkt. Dann finden auch sie einen Partner. Allerdings passen die N-terminalen Domänen in den bereits parallel verknüpften Proteine nicht zusammen. Zwei N-terminale Domänen verklammern sich nur miteinander, wenn sie antiparallel angeordnet sind; nur in diesem Fall können ihre Strukturen – ähnlich wie Yin und Yang – ineinandergreifen. Daher müssen die N-terminalen Domänen der Dimere sozusagen fremdgehen und sich mit einer N-terminalen Domäne aus einem anderen Paar verklammern. Die nun ineinander greifenden Domänen sind anders als die C-terminalen Domänen nicht chemisch verbunden, sondern nur physikalisch miteinander vernetzt.
Dieses ungewöhnliche Vernetzungsprinzip macht aus den einzelnen Seidenproteinen eine Kette aus perfekt angeordneten Molekülen. Wenn sich diese Kette faltet, können die Aminosäuresequenzen, welche die Kerndomänen der einzelnen Proteine bilden, sich punktgenau aneinanderlagern. Dies ist eine wesentliche Voraussetzung für die extreme Belastbarkeit der natürlichen Spinnenseidenfasern, die nun – dem ‚Know-how‘ der Spinne folgend – in Bayreuth erfolgreich nachgebaut wurde.
Author
Christian Wißler
Source
Universität Bayreuth, Pressemitteilung, 2015-02-23.
Supplier
Advanced Materials (Wiley)
Hochschule Coburg
Technologie Allianz Oberfranken (TAO)
Universität Bamberg
Universität Bayreuth
Share
Renewable Carbon News – Daily Newsletter
Subscribe to our daily email newsletter – the world's leading newsletter on renewable materials and chemicals










